Проверка закона Бойля - Мариотта
Цель:проверить правильность закона Бойля-Мариотта при изотермическом процессе.
Приборы и оборудование: цилиндр переменного объёма (сильфон), манометр демонстрационный закрытый со шкалой 0-1.6 атм., трубка резиновая.
Теория
Уравнение состояния идеального газа описывается уравнением
p=nkT
где p - давление газа, n - его концентрация, k = 1.38∙10-23 Дж/К - постоянная Больцмана, T -температура. Другой вид этого уравнения известен как уравнение Менделеева-Клапейрона:
pV=m/M∙RT.
Здесь m - масса газа, M - его молярная масса, V - объем газа, R=8.31 Дж/(моль∙К) - газовая постоянная.
Всякое изменение термодинамического состояния тела (температуры, давления, объема) называется термодинамическим процессом. Изопроцессами называют термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы. Из уравнения Менделеева-Клапейрона для каждого изопроцесса можно получить некоторые уравнения, называемые газовыми законами. Первоначально эти законы были получены экспериментально, и данная работа позволяет представить, каким образом это было сделано.
Изотермическим называется термодинамический процесс, протекающий при неизменной температуре. Он подчиняется закону Бойля-Мариотта: для данной массы газа при неизменной температуре произведение численных значений давления и объема есть величина постоянная
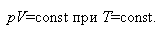 |
(7.1) |
Изобарическим называется процесс, при котором давление остается постоянным. Для него справедлив закон Гей-Люссака: при постоянном давлении объем массы газа прямо пропорционален его абсолютной температуре
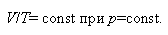 |
(7.2) |
Изохорным процессом называется термодинамический процесс, протекающий при постоянном объеме. Он описывается законом Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
 |
(7.3) |
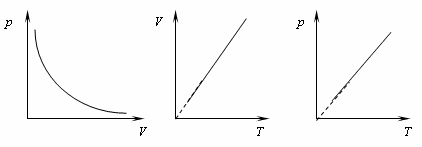
Рис. 6. Графическое представление изопроцессов: а- изотермический, б- изобарный, в- изохорный
Адиабатическим процессом называется термодинамический процесс, который осуществляется в системе без теплообмена с внешними телами. Как правило, быстрые процессы, при которых теплообмен с внешней средой не успевает происходить, являются адиабатическими. Известно, что при адиабатическом расширении газа он охлаждается, а при адиабатическом сжатии - нагревается. Например, при сжатии газа в велосипедном насосе он нагревается. В данной работе хороший теплообмен газа в сильфоне с атмосферой обеспечивается за счет высокой теплопроводности и большой поверхности его металлической стенки, а также относительно медленным перемещением винта, поэтому процесс не является адиабатическим.
Описание работы и ход эксперимента

Основная часть прибора (рис.7) - закрытый гофрированный цилиндр 1 (сильфон), который соединяется с наружным воздухом только через небольшой изогнутый патрубок 2, впаянный в металлическую крышку 3. Сильфон при помощи винта 4 можно растягивать, причём объём воздуха, заключённый внутри прибора, изменяется пропорционально изменению высоты. Объём газа измеряется в условных единицах по прикреплённой к прибору демонстрационной шкале с десятью делениями. Указателем при таких измерениях служит край крышки сильфона 3. Начальный объём сильфона - пять условных единиц, а конечный - десять. Чтобы нельзя было растянуть сильфон сверх нормы, на стойки надеты две небольшие трубки-ограничители 5.
Таблица
Результаты опыта по проверке закона Бойля-Мариотта
| N0 | Объем V, усл. ед. | Давление p, атм | Произведение Vp |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 |
Контрольные вопросы