Методы обезвреживания и переработки промышленных отходов, применяемые для защиты биосферы от загрязнений, несмотря на многообразие химических отходов, ограниченны. Для выбора метода и технологического подхода необходимо дать оценку их эффективности и определить области рационального применения каждого метода. Широко применяемые регенерационные методы переработки отходов максимально используют химические соединения, находящиеся в отходах. настоящее время с целью очистки сточных вод до санитарных норм оптимальными методами являются адсорбция и ионный обмен. Адсорбционный метод нашел широкое применение в промышленности при регенерации органических растворителей, очистке газов, паров и жидкостей. Его достоинством является возможность адсорбции соединений из многокомпонентных смесей, а также высокая эффективность при очистке низкоконцентрированных сточных вод. Наиболее эффективными промышленными адсорбентами являются активные угли.
Адсорбент в процессе очистки используется многократно, после чего его подвергают регенерации. Регенерация адсорбента является одним из основных вопросов при адсорбционной очистке, от решения которого зависит возможность применения метода и его стоимость. Скорость адсорбции зависит от концентрации, природы и структуры улавливаемых соединений, температуры, рН среды, вида и свойств адсорбента.
В общем случае процесс адсорбции состоит из трех стадий: переноса соединения к поверхности адсорбента, собственно адсорбции, переноса соединений внутри зерна адсорбента. На первой стадии процесс лимитируется скоростью движения сточной воды, а на третьей - видом адсорбента и размером его пор, формой и размером его зерен, размером молекул адсорбируемых соединений.
В промышленности адсорбция осуществляется в аппаратах периодического и непрерывного действия. Интенсификация процессов адсорбции идет по пути использования псевдоожиженного слоя адсорбентов. Например, при очистке сточных вод от фенола в псевдоожиженном слое адсорбента 0,8-3 м достигнута производительность 9-15 м3 /ч при степени извлечения 99,9 % и исходной концентрации 1 г/л [1] .
Метод ионного обмена основан на улавливании катионов и анионов химических соединений естественными материалами или синтетическими смолами с последующей регенерацией последних. Для очистки сточных вод от катионов применяют искусственные смолы (катиониты КУ-2, КУ-1), органические катиониты (сульфоуголь СМ-1, СК-1) и природные минеральные катиониты (вермикулит, доломит, глауконит и др.). Метод применим в основном для очистки сточных вод, он позволяет извлечь из воды более токсичные ионы, заменив их менее опасными, получить стоки, однородные по катионам и анионам [2].
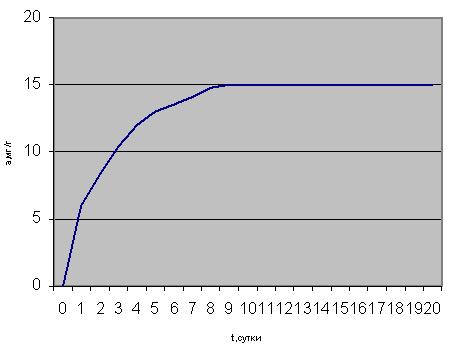
Целью наших экспериментальных исследований являлось установление предварительной оценки сорбционной способности исследуемых полиминеральных образований по отношению к ряду токсичных органических соединений: фенолу и ксилолам. Для этого был использован классический весовой метод. Полученные в результате проведенного эксперимента кинетические кривые сорбции паров фенола приведены на рисунке 1.
Максимальное количество фенола поглощает 1 образец - 61 мг/г, причем насыщение его парами фенола растянуто во времени и составляет 12 - 14 суток. Меньшим количеством поглощенного фенола характеризуются 4, 2 и 5-ый образцы : 46 мг/г, 40 мг/г и 37 мг/г соответственно. Для них временной промежуток установления сорбционного равновесия также длителен и составляет 16-18 суток.
Иной механизм сорбции характерен для ксилолов (таблица 1). Особенностью его поглощения природными минеральными сорбентами является наличие максимумов на кинетических кривых сорбции.
Таблица 1
Показатели сорбции паров ксилола минеральными сорбентами
| Показатели |
Образцы |
| 1 |
2 |
3 |
4 |
5 |
6 |
Время установления
сорбционного равновесия, (сутки) * |
1,5
6 |
1
6 |
4
8 |
1,5
7 |
1
3 |
2
5 |
Максимальная величина
сорбции ксилолов, мг/ |
22 |
18 |
14 |
16 |
14 |
6 |
Конечная величина
сорбции ксилолов, мг/г |
12 |
8 |
10 |
3 |
4 |
1 |
* - первая строка - период сорбции, соответствующий максимальному поглощению ксилолов,
* - вторая строка - общий временной период процесса сорбции-десорбции.
Так, например, 2 и 4 образцы поглощают максимальное количество ксилолов за сутки - 18 мг/г и 16 мг/г соответственно. Затем на протяжении шести и семи суток соответственно наблюдается частичная десорбция первоначально поглощенного ксилола, в результате чего остаточная величина сорбции для 2 и 4 образцов составила 8 мг/г и 3 мг/г соответственно. Из представленных исследуемых образцов наибольшая остаточная величина сорбции характерна для 1 образца - 12 мг/г. В результате десорбции ксилола его остаточное поглощенное количество для 4 и 6 образцов составляет 20 % и 17 % соответственно.
Меньшее количество поглощаемых паров ксилолов по сравнению с фенолом. Очевидно, связано с пространственными затруднениями, которые испытывают объемные молекулы ксилолов при их сорбции как во внешнем объеме пор, так и во внутреннем объеме пор исследуемых сорбентов. Проводимые нами исследования будут продолжены для наработки базы данных по формальдегиду, этанолу, уксусной кислоте.
Рисунок 1 Изотермы сорбции фенола образцами минеральных сорбентов (N1-N7).
N1

N2

N3

N4
N5

N6

Литература
- Когановский А.М. Очистка промышленных сточных вод. Киев: Техника, 1974. 257с.
- Когановский А.М., Клименко Н.А. Физико-химические методы очистки промышленных сточных вод от поверхностно-активных веществ.Киев: Наукова думка, 1974.180 с.